2022年10月17日,我院沈洪兵、胡志斌课题组在国际顶尖肿瘤学期刊《柳叶刀·肿瘤》(The Lancet Oncology)上发表了题为“嵌合常染色体变异与多基因遗传风险评分的交互作用与肺癌发病风险的关联研究:一项基于基因分型芯片技术的病例对照和前瞻性队列研究”(Association of the interaction between mosaic chromosomal alterations and polygenic risk score with the risk of lung cancer: an array-based case-control association and prospective cohort study)的研究论文。

嵌合染色体变异(Mosaic chromosomal alterations,mCAs)是一类在造血干细胞分化过程中由于DNA复制错误未得到正确修复而产生的基因组改变,自胚胎发育时起随着生物年龄的增长不断在体内积累,是内外环境暴露因素在基因组上留下的印记。近年来,已有多项研究证实mCAs与实体肿瘤、心血管疾病及其他慢性病发病风险相关,然而目前尚没有研究探讨mCAs与肺癌发病风险的关联。因此,描绘mCAs的特征谱,明确其与肺癌发生风险的关联,揭示其与遗传因素的交互作用,有助于探索肺癌进展过程中“基因组失稳”和相关生物学机制,进一步优化肺癌的二级预防。
沈洪兵、胡志斌团队利用大规模人群的全基因组基因分型芯片数据,首次发现mCAs,尤其是嵌合拷贝丢失变异,与肺癌发病风险增加显著相关,并与多基因遗传风险评分(Polygenic risk scores,PRS)存在协同作用,两者对肺癌发病风险的联合效应呈剂量-反应关系。上述结论在来自中国汉族人群的南京肺癌队列(Nanjing Lung Cancer Cohort,NJLCC)和来自于英国生物银行(UK Biobank,UKB)的欧洲人群中均得到证实。作者认为mCAs作为一类新型的基因组标志物,可与PRS协同用于肺癌发病风险的预测,从而提高肺癌早期筛查、预防和干预的效果。
首先,作者募集了来自中国南方、中部和北方三地区的10248例肺癌患者和9298例对照以及来自UKB队列的450821例欧洲人群样本。通过比较发现,与不携带mCAs的个体相比,中国人群和欧洲人群中携带mCAs的个体发生肺癌的风险分别增加19%和24%。进一步的亚型分析结果发现,mCAs与肺癌的关联效应主要来自嵌合拷贝丢失变异:相比于不携带mCAs的个体,携带嵌合拷贝丢失变异的个体发生肺癌的风险分别增加81%和40%,并且该效应在携带克隆扩增(细胞比例≥10%)的嵌合拷贝丢失变异事件的个体中更强。
随后,作者进一步研究了mCAs与PRS之间的交互作用,并发现,不论是中国汉族人群还是欧洲人群,嵌合拷贝丢失变异和PRS之间存在显著的相乘和相加交互作用,且两者对肺癌发病风险的联合效应呈剂量-反应关系(图1):与低遗传风险且不携带嵌合拷贝丢失变异的人群相比,高遗传风险且携带嵌合拷贝丢失变异的人群发生肺癌的风险分别增加5.05倍(NJLCC)和2.75倍(UKB)。此外,嵌合拷贝丢失变异与PRS存在正向相加交互作用:在NJLCC研究中,由高遗传风险和嵌合拷贝丢失变异间相加交互作用引起的超额相对危险度(Relative Excess Risk of Interaction,RERI)为3.67,约占该组人群肺癌发病风险效应的61%;在UKB研究中,由高遗传风险和嵌合拷贝丢失变异间相加交互作用引起的RERI为2.15,约占该组人群肺癌发病风险效应的67%。
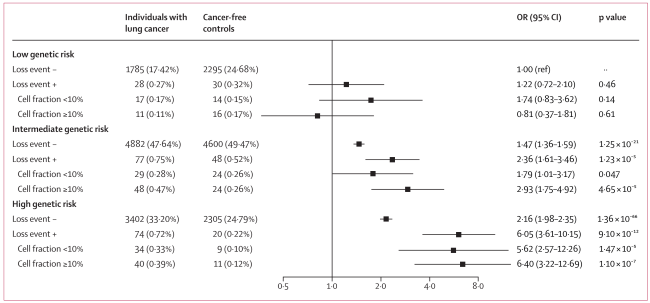
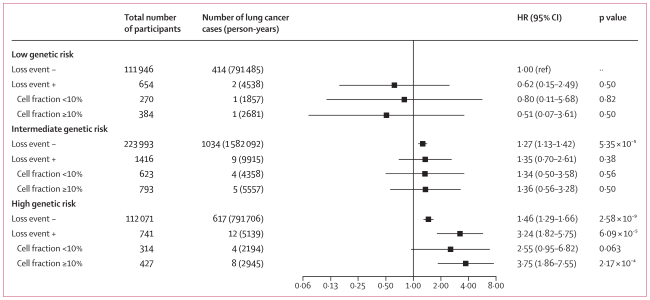
图1. 嵌合拷贝丢失变异与多基因遗传风险评分协同增加肺癌的发病风险(上图为NJLCC研究结果,下图为UKB研究结果)
综上所述,该研究首次提出mCAs可作为一类新型基因组标志物预测肺癌的发病风险,并且可与PRS联合使用优化肺癌的个体化风险评估。由于mCAs的检测仅需低成本的基因分型芯片,并且可在整个生命周期进行动态监测,将mCAs纳入已有肺癌风险预测模型将有助于完善肺癌高危人群的识别策略,为肺癌的精准预防和精准诊疗提供重要的理论依据。然而,现有关于mCAs和疾病风险的人群关联研究多基于病例-对照设计,无法区分合子形成后发生的嵌合变异和传递自父母的遗传变异。同时我们也注意到,mCAs自胚胎发育起即可发生,其来源及影响肺癌发生的具体生物学机制目前尚无系统研究。因此,基于核心家系(父-母-子代)设计的大规模出生队列研究将有助于优化mCAs的检测,同时可自出生起对mCAs进行长时间的追踪和动态监测,有助于深入解析mCAs的成因、自然史以及其影响复杂疾病发生的生物学机制。
